Pengertian Enzim
Enzim adalah golongan protein yang paling banyak terdapat dalam sel hidup. Sekarang, kira-kira lebih dari 2.000 enzim telah teridentifikasi, yang masing-masing berfungsi sebagai katalisator reaksi kimia dalam sistem hidup. Sintesis enzim terjadi di dalam sel dan sebagian besar enzim dapat diperoleh dengan ekstraksi dari jaringan tanpa merusak fungsinya.
Sebagai katalisator, enzim berbeda dengan katalisator anorganik dan organik sederhana yang umumnya dapat mengatalisis berbagai reaksi kimia, Enzim memiliki spesifitas yang sangat tinggi, baik terhadap reaktan (substrat) maupun jenis reaksi yang dikatalisiskan. Pada umumnya, suatu enzim hanya mengatalisis satu jenis reaksi dan bekerja pada suatu susbstrat tertentu. Kemudian, enzim dapat meningkatkan laju reaksi yang luar biasa tanpa pembentukan produk samping dan molekul berfungsi dalam larutan encer pada keadaan biasa (fisiologis) tekanan, suhu, dan pH normal. Hanya sedikit katalisator nonbiologi yang dilengkapi sifat-sifat demikian.
Enzim merupakan unit fungsional dari metabolisme sel. Enzim bekerja dengan urutan-urutan yang teratur dan mengkatalisis ratusan reaksi dari reaksi yang sangat sederhana seperti replikasi kromosom sampai ke reaksi yang sangat rumit, misalnya reaksi yang menguraikan molekul nutrient; menyimpan; dan mengubah energi kimiawi. Masing-masing reaksi dikatalisis oleh sejenis enzim tertentu. Di antara sejumlah enzim tersebut, ada sekelompok enzim yang disebut enzim pengatur (enzim allosterik). Enzim dapat mengenali berbagai isyarat metabolis yang diterima. Melalui aktivitasnya, enzim pengatur mengkoordinasikan sistem enzim dengan baik, sehingga menghasilkan hubungan harmonis diantara sejumlah aktivitas metabolis yang berbeda.
Pada keadaan abnormal atau aktivitas berlebihan suatu enzim dapat menimbulkan penyakit. Analisis enzim dalam serum dapat digunakan untuk mendiagnosis penyakit, seperti: infarktus otot jantung, prostat, hepatitis, dan lain-lain. Ditemukannya suatu enzim dalam darah dengan tingkat berlebihan seringkali menunjukkan adanya kerusakan sel di dalam organ yang sakit. Penyakit tertentu seperti hepatitis terinfeksi menyebabkan jaringan hati mengalami kerusakan akibat infeksi, sehingga terjadi pelepasan enzim hati ke dalam darah.
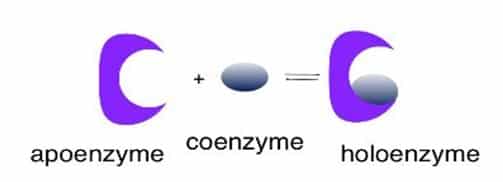
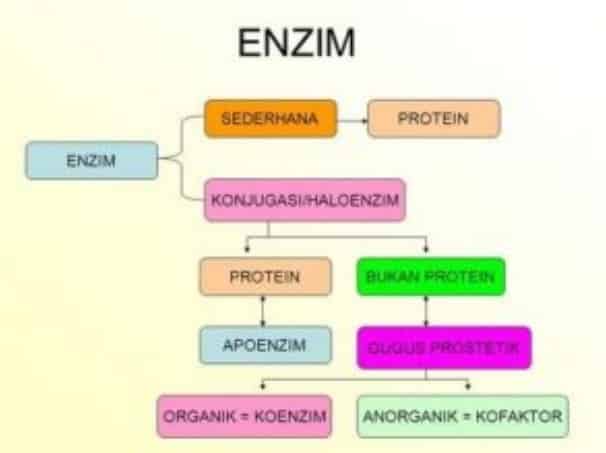
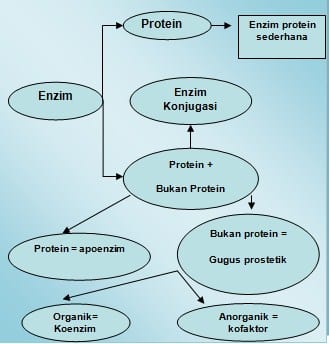
Semua enzim pada hakikatnya adalah protein. Beberapa di antaranya mempunyai struktur agak sederhana, sedangkan sebagian besar lainnya memiliki struktur rumit. Namun, kebanyakan enzim baru berfungsi sebagai katalis apabila disertai zat lain yang bukan protein, yang disebut atau Cu2+, tetapi dapat pula berupa molekul organik kompleks yang disebut koenzim. Bagian protein dari enzim disebut apoenzim. Kemudian, gabungan apoenzim dan kofaktornya sehingga enzim menjadi aktif disebut holoenzim.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian Enzim dan Fungsinya
Struktur Enzim
- Komponen utama enzim adalah protein
- Protein yang sifatnya fungsional, bukan protein structural
- Tidak semua protein bertindak sebagai enzim
Hal yang berkaitan dengan enzim dipelajari dalam enzimologi. Dalam dunia pendidikan tinggi, enzimologi tidak dipelajari tersendiri sebagai satu jurusan tersendiri tetapi sejumlah program studi memberikan mata kuliah ini. Enzimologi terutama dipelajari dalam kedokteran, ilmu pangan, teknologi pengolahan pangan, dan cabang-cabang ilmu pertanian
SUBSTRAT adalah substansi yang mengalami perubahan kimia setelah bercampur dengan enzim, sedangkan PRODUK adalah substansi baru yang terbentuk setelah reaksi mencapai keseimbangan. APOENZIM bagian enzim yang merupakan protein, mempunyai struktur 3 dimensi. Pada enzim tersebut sangat penting untuk aktifitas kalalisis, oleh karena itu perubahan konformasi yang sedikit saja pada struktur enzim akan mempengaruhi aktifitasnya. Seperti protein pada umumnya enzim dapat mengalami denaturasi oleh berbagai faktor, seperti : perubahan pH yang mencolok, temperatur, pelarut organik, urea dan dapat dihambat oleh racun enzim.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian dan Bagian Sel Saraf
Sifat-sifat Enzim
Sifat enzim yang sangat penting adalah tingginya efisiensi dan derajat spesifitas katalitik enzim terhadap substrat. Efisiensi katalitik enzim berkaitan dengan orientasi optimum gugus aktiv enzim dan substrat. Orientasi keduanya sangat mendukung sehingga saat terjadi reaksi tidak memerlukan energy yang besar untuk mengatur posisi. Spesifitas enzim berkaitan dengan reaksi enzim yang sangat spesifik, satu enzim hanya akan bereaksi dengan satu substrata tau setiap enzim menyebabkan satu perubahan satu langkah pada substratnya.
Enzim memiliki beberapa kekhususan dalam mengkatalisis satu reaksi substrat menjadi produk. Pertama adalah kekhususan mutlak yaitu kekhususan enzim yang mempunyai sisi aktif tertata baik dan kaku sehingga enzim tersebut hanya mampu mengkatalisis satu reaksi substrat menjadi produk. Kedua, kekhususan nisbi yaitu kekhususan enzim yang dapat mengkatalisis jenis reaksi sama dengan lebih dari satu substrat yang memiliki kemiripan struktur. Kekhususan ini memerlukan sisi aktif enzim yang lebih luwes. Ketiga, enzim memiliki kekhususan ruang yaitu kekhususan enzim dalam membedakan gugus kimia yang sama pada suatu substrat. Misalnya gliserolkinase (katalisis gliserol menjadi gliserolfosfat dan ATP sebagai donor fosfat) yang secara teori dapat memindahkan gugus fosfat ke gugus hidroksil karbon, menghasilkan stereoisomer D dank e gugus hidroksil karbon 3 menghasilkan stereoisomer L dengan pelua
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian dan Bagian Sel beserta Menurut Para Ahli
Mekanisme Kerja Enzim
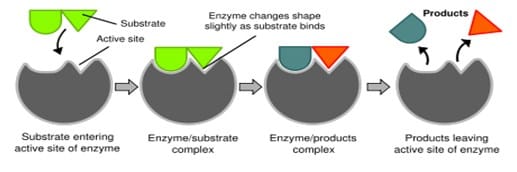
Secara garis besar ada tiga tahap kerja enzim (E) pada substrannya (S).
Pertama, susbstrat melekat pada enzim dengan ikatan nonkovalen membentuk kompleks enzim substrat. Kedua, enzim melakukan reaksi kimia pada substrat membentuk kompleks enzim-produk. Tahap ketiga, produk meninggalkan sisi aktif enzim dan enzim tersebut siap melakukan proses yang sama pada substrat yang baru.
-
Model “kunci dan gembok”
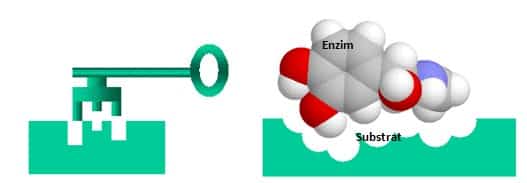
Enzim sangatlah spesifik. Pada tahun 1894, Emil Fischer mengajukan bahwa hal ini dikarenakan baik enzim dan substrat memiliki bentuk geometri yang saling memenuhi. Hal ini sering dirujuk sebagai model “Kunci dan Gembok”. Manakala model ini menjelaskan kespesifikan enzim, ia gagal dalam menjelaskan stabilisasi keadaan transisi yang dicapai oleh enzim. Model ini telah dibuktikan tidak akurat, dan model ketepatan induksilah yang sekarang paling banyak diterima.
-
Model ketepatan induksi
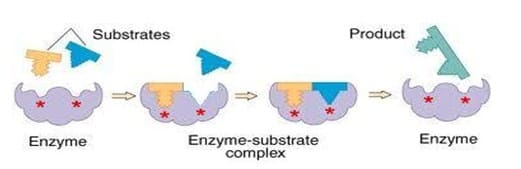
Pada tahun 1958, Daniel Koshland mengajukan modifikasi model kunci dan gembok: oleh karena enzim memiliki struktur yang fleksibel, tapak aktif secara terus menerus berubah bentuknya sesuai dengan interaksi antara enzim dan substrat. Akibatnya, substrat tidak berikatan dengan tapak aktif yang kaku. Orientasi rantai samping asam amino berubah sesuai dengan substrat dan mengijinkan enzim untuk menjalankan fungsi katalitiknya. Pada beberapa kasus, misalnya glikosidase, molekul substrat juga berubah sedikit ketika ia memasuki tapak aktif. Tapak aktif akan terus berubah bentuknya sampai substrat terikat secara sepenuhnya, yang mana bentuk akhir dan muatan enzim ditentukan.
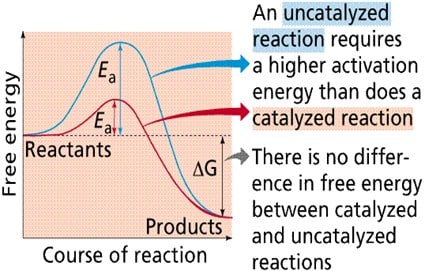
Enzim dapat bekerja dengan beberapa cara, yang kesemuanya menurunkan Ea :
- Menurunkan energi aktivasi dengan menciptakan suatu lingkungan yang mana keadaan transisi terstabilisasi (contohnya mengubah bentuk substrat menjadi konformasi keadaan transisi ketika ia terikat dengan enzim.)
- Menurunkan energi keadaan transisi tanpa mengubah bentuk substrat dengan menciptakan lingkungan yang memiliki distribusi muatan yang berlawanan dengan keadaan transisi.
- Menyediakan lintasan reaksi alternatif. Contohnya bereaksi dengan substrat sementara waktu untuk membentuk kompleks Enzim-Substrat antara.
- Menurunkan perubahan entropi reaksi dengan menggiring substrat bersama pada orientasi yang tepat untuk bereaksi. Menariknya, efek entropi ini melibatkan destabilisasi keadaan dasar, dan kontribusinya terhadap katalis relatif kecil. (Mathews: 1999)
-
Inhibisi
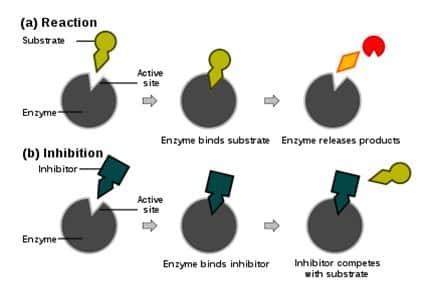
Inhibitor kompetitif mengikat enzim secara reversibel, menghalangi pengikatan substrat. Di lain pihak, pengikatn substrat juga menghalangi pengikatan inhibitor. Substrat dan inhibitor berkompetisi satu sama lainnya.
Jenis-jenis inihibisi
Klasifikasi ini diperkenalkan oleh W.W. Cleland. Laju reaksi enzim dapat diturunkan menggunakan berbagai jenis inhibitor enzim.
- Inhibitor competitive
Pada inihibisi kompetitif, inhibitor dan substrat berkompetisi untuk berikatan dengan enzim. Seringkali inhibitor kompetitif memiliki struktur yang sangat mirip dengan substrat asli enzim. Sebagai contoh, metotreksat adalah inihibitor kompetitif untuk enzim dihidrofolat reduktase. Kemiripan antara struktur asam folat dengan obat ini ditunjukkan oleh gambar di samping bawah. Perhatikan bahwa pengikatan inhibitor tidaklah perlu terjadi pada tapak pengikatan substrat apabila pengikatan inihibitor mengubah konformasi enzim, sehingga menghalangi pengikatan substrat. Pada inhibisi kompetitif, kelajuan maksimal reaksi tidak berubah, namun memerlukan konsentrasi substrat yang lebih tinggi untuk mencapai kelajuan maksimal tersebut, sehingga meningkatkan Km. - Inhibitor non-competitive
Inhibitor non-kompetitif dapat mengikat enzim pada saat yang sama substrat berikatan dengan enzim. Baik kompleks EI dan EIS tidak aktif. Karena inhibitor tidak dapat dilawan dengan peningkatan konsentrasi substrat, Vmax reaksi berubah. Namun, karena substrat masih dapat mengikat enzim, Km tetaplah sama. - Inhibisi campuran
Inhibisis jenis ini mirip dengan inhibisi non-kompetitif, kecuali kompleks EIS memiliki aktivitas enzimatik residual. Pada banyak organisme, inhibitor dapat merupakan bagian dari mekanisme umpan balik. Jika enzim memproduksi terlalu banyak produk, produk tersebut dapat berperan sebagai inhibitor bagi enzim tersebut. Hal ini akan menyebabkan produksi produk melambat atau berhenti. Bentuk umpan balik ini adalah umpan balik negatif. Enzim memiliki bentuk regulasi seperti ini sering kali multimerik dan mempunyai tapak ikat alosterik. Kurva substrat/kelajuan enzim ini tidak berbentuk hiperbola melainkan berbentuk S.
Baca Juga Artikel Yang Mungkin Berhubungan : Komponen Penyusun Darah Manusia dan Fungsinya
Macam Enzim dan Fungsinya
Di dalam tubuh manusia, ada banyak macam-macam enzim . Ciri khas enzim ialah, enzim hanya dapat bekerja pada substrat tertentu saja. Ini artinya, setiap jenis enzim memiliki fungsi yang berbeda-beda, bereaksi pada substrat yang berbeda-beda dan juga menghasilkan produk yang berbeda pula. Setiap jenis enzim memiliki tugas uang spesifik, contohnya memperkuat sistem kekebalan tubuh, memecahkan makanan, menguraikan toksin, menetralkan darah, dan juga memecahkan protein menjadi asam amino. Enzim bisa digolongkan berdasarkan kelompok substrat yang dipengaruhinya. Enzim juga bisa digolongkan berdasarkan peristiwa yang terjadi di dalam reaksi. Berdasarkan peristiwa yang terjadi di dalam reaksi. enzim dibagi menjadi dua golongan meliputi enzim hidrolase dan enzim desmolase. Enzim hidrolase adalah golongan enzim yang dapat berfungsi apabila terdapat peran air didalamnya, contohnya enzim lipase. Enzim desmolase sendiri ialah golongan enzim yang dapat memecah ikatan C-C dan C-N, contohnya enzim katalase.
Berdasarkan substrat yang dipengaruhinya, enzim dibagi menjadi tiga golongan utama, yaitu enzim karbohidrase, enzim protease, dan enzim esterase. Golongan Enzim Karbohidrase merupakan golongan enzim yang berfungsi untuk memecah karbohidrat substratnya. Macam-macam enzim yang masuk ke dalam golongan ini antara lain yaitu sebagai berikut:
- Enzim selulose merupakan enzim yang berperan menguraikan selulosa menjadi selobiosa.
- Enzim amilase, merupakan enzim yang berperan mengurai amilum atau polisakarida menjadi senyawa maltosa.
- Enzim pektinase, merupakan enzim yang berfungsi mengurai pektin menjadi senyawa asam pektin.
- Enzim maltose, merupakan enzim yang berfungsi mengurai maltosa menjadi senyawa glukosa.
- Enzim sukrosa, merupakan enzim yang berperan mengubah sukrosa menjadi senyawa glukosa dan juga fruktosa.
- Enzim laktosa, merupakan enzim yang berperan mengubah senyawa laktosa menjadi senyawa galaktosa dan juga glukosa.
Golongan enzim berikutnya ialah golongan enzim protease. Protease merupakan golongan untuk enzim yang bereaksi dalam proses pemecahan protein. Macam-macam enzim yang termasuk golongan protease diantaranya adalah:
- Enzim pepsin,ialah enzim yang berperan dalam pemecahan senyawa protein yang kemudian diubah menjadi senyawa asam amino.
- Enzim tripsin, ialah enzim yang berperan mengurai pepton menjadi senyawa asam amino.
- Enzim entrokinase, ialah enzim yang berperan proses penguraian senyawa pepton menjadi senywa asam amino.
- Enzim peptidase, ialah enzim yang berperan dalam proses penguraian senyawa peptida menjadi senyawa asam amino.
- Enzim renin, ialah enzim yang berperan sebagai penguraian senyawa kasein dan juga susu.
- Enzim gelatinase, ialah enzim yang berperan dalam mengurai senyawa gelatin.
Golongan yang ketiga ialah enzim esterase. Enzim esterase merupakan golongan enzim yang berguna untuk menguraikan substrat yang termasuk ke dalam golongan ester. Macam-macam enzim yang masuk ke dalam golongan ini antara lain sebagai berikut:
- Enzim lipase, yaitu enzim yang berperan dalam menguraikan lemak menjadi senyawa gliserol serta asam lemak.
- Enzim fostatase, yaitu enzim yang berperan dalam menguraikan suatu ester dan mendorong terjadinya pelepasan asam fosfor.
Baca Juga Artikel Yang Mungkin Berhubungan : Pengertian dan Jenis Vaksin Beserta Manfaatnya
Faktor Mempengaruhi Aktivitas Enzim
Seperti molekul protein lainnya sifat biologis enzim sangat dipengaruhi berbagai faktor fisikokimia. Enzim bekerja pada kondisi tertentu yang relatif ketat. Faktor-faktor yang mempengaruhi kerja enzim antara lain:
-
Suhu
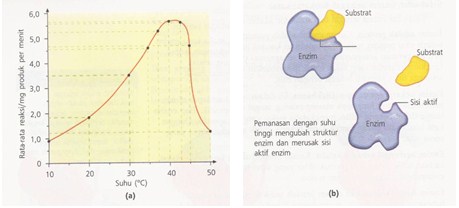
Pada suhu yang lebih tinggi, kecepatan molekul substrat meningkat, sehingga pada saat bertumbukan dengan enzim, energi molekul substrat berkurang. Hal ini memudahkan terikatnya molekul substrat pada sisi aktif enzim. Aktivitas enzim meningkat dengan meningkatnya suhu sampai pada titik tertentu. Peningkatan suhu meningkatkan energi kinetik pada molekul substrat dan enzim, sehingga kecepatan reaksi meningkat pula. Perbandingan yang tepat di mana kecepatan berubah untuk setiap kenaikan temperatur 10° C adalah Q10, atau koefisien temperatur. Kecepatan banyak reaksi biologis kurang lebih naik dua kali dengan kenaikan temperatur 10° (Q10 = 2), dan menjadi setengahnya bila temperatur diturunkan dengan 10°.
Namun, tidak berarti bahwa peningkatan ini berlangsung tidak terbatas. Kecepatan enzim dalam mengkatalis reaksi mencapai puncaknya pada suhu tertentu. Suhu ini disebut suhu optimum enzim. Untuk kebanyakan enzim, suhu optimal adalah suhu sel atau suhu di atas suhu sel di mana enzim-enzim terdapat di dalamnya. Suhu optimum enzim berkisar antara 25° – 40° C. (Yasied: 2006)
Kenaikan kecepatan di bawah suhu optimal disebabkan oleh kenaikan energi kinetika molekul-molekul yang bereaksi. Akan tetapi bila suhu tetap dinaikkan terus, energi kinetik molekul-molekul enzim menjadi demikian besar sehingga melampaui energi penghalang untuk memecahkan ikatan-ikatan sekunder yang mempertahankan enzim dalam keadaan aslinya atau keadaan katalitik aktif. Akibatnya struktur sekunder dan tersier hilang disertai hilangnya aktivitas katalitik. Peningkatan suhu yang semakin tinggi menyebabkan putusnya ikatan hidrogen dan ikatan lain yang merangkai molekul enzim, sehingga enzim mengalami denaturasi. Denaturasi menyebabkan aktivitas enzim menurun atau hilang.
-
pH
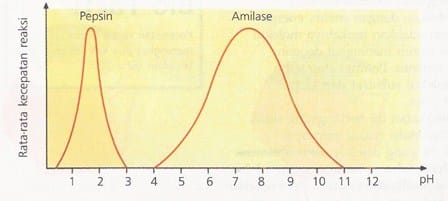
pH juga mempengaruhi aktivitas enzim. Perubahan kondisi asam dan basa di sekitar molekul enzim mempengaruhi benuk tiga dimensi enzim dan dapat menyebabkan denaturasi. Setiap enzim memiliki pH optimum. Misalnya, pepsin (enzim yang bekerja di dalam lambung) mempunyai pH optimum sekitar 2 (sangat asam), sedangkan amilase (enzim yang bekerja di mulut dan usus halus) memiliki pH optimum sekitar 7,5 (agak basa).
-
Konsentrasi Enzim
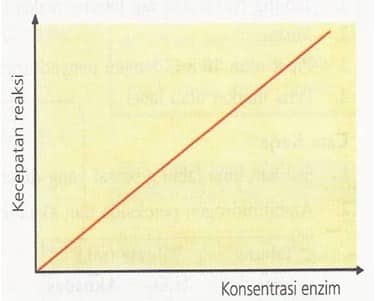
Semakin besar konsentrasi enzim semakin cepat pula reaksi yang belangsung. Dengan kata lain konsentrasi enzim berbanding lurus dengan kecepatan reaksi. Sisi aktif suatu enzim dapat digunakan berulang kali oleh banyak substrat. Substrat yang berikatan dengan sisi aktif enzim akan membentuk produk. Pelepasan produk menyebabkan sisi aktif enzim bebas untuk berikatan dengan substrat lainnya. Oleh karenanya hanya dibutuhkan sejumlah kecil enzim untuk mengkatalis sejumlah besar substrat.
-
Konsentrasi Substrat
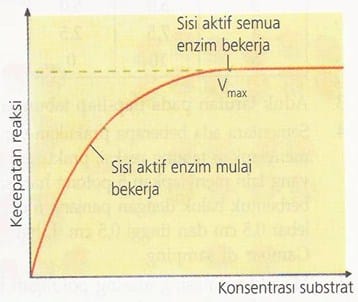
Bila sejumlah enzim dalam keadaan tetap, kecepatan reaksi akan meningkat dengan adanya peningkatan konsentrasi substrat. Namun, pada saat sisi aktif semua enzim bekerja, penambahan substrat tidak dapat meningkatkan kecepatan reaksi enzim lebih lanjut. Kondisi ini disebut konsentrasi substrat pada titik jenuh atau disebut kecepatan maksimum (Vmax).
-
Inhibitor
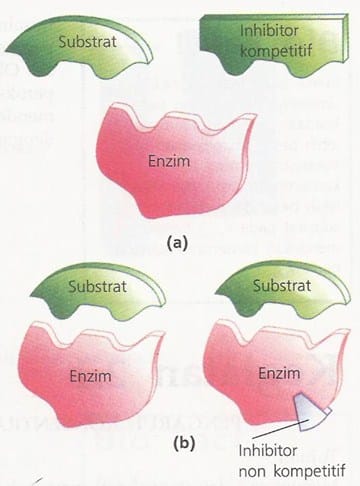
Inhibitor merupakan suatu molekul yang menghambat ikatan enzim dengan substratnya. Ada dua macam inhibitor enzim, yaitu inhibitor kompetitif dan non-kompetitif.
Inhibitor kompetitif adalah molekul penghambat yang cara kerjanya bersaing dengan substrat untuk mendapatkan sisi aktif enzim. Contohnya, sianida bersaing deengan oksigen untuk mmendapatkan Hb dalam rantai respirasi terakhir. Inhibitor kompetitif dapat diatasi dengan cara penambahan konsentrasi substrat.
Inhibitor non-kompetitif adalah molekul penghambat enzim yang bekerja dengan cara melekatkan diri pada luar sisi aktif, sehingga bentuk enzim berubah, dan sisi aktif tidak dapat berfungsi.